표면형광 현미경 (epifluorescent microscopy)

형광현미경의 가장 기본적인 형태는 광시야 형광현미경으로도 알려진 표면형광 현미경이다. 형광 프로브로 표지된 표본은 여기 파장의 빛에 의해 조명된다 (그림 A). 그런 다음 파장에는 불투명하지만 방출된 빛의 더 긴 파장을 투과시키는 두 번째 필터를 사용하여 표본을 본다. 따라서 접안렌즈를 통해 투과되는 유일한 빛은 표본에서 방출되는 빛이다.
Epifluorescence는 훌륭한 도구이지만 한 가지 주요 단점이 있다. 빛은 표본의 전체 깊이에 걸쳐 형광단을 여기시킨다. 따라서 형광 신호는 초점면뿐만 아니라 이 평면의 위와 아래 영역에서도 수집된다. 이러한 배경 형광은 흐릿하고 대비가 부족한 흐릿하고 초점이 맞지 않는 이미지로 이어질 수 있다. 따라서 상대적으로 두꺼운 표본 (> 15 ~ 30μm)에서 형광성의 값은 제한적이다. 형광 현미경의 대체 형태는 초점이 맞지 않는 형광을 제한하여 더 선명하고 선명한 형광 이미지를 생성하려고 시도한다.
공초점 현미경 (Confocal Microscopy)

공초점 현미경은 표본의 얇은 (< 1μm) 영역에서 빛을 선택적으로 수집하여 비교적 두꺼운 표본 내의 구조에 대한 선명한 이미지를 생성한다. 그것은 뇌 조각 또는 초파리 또는 배아 제브라피쉬와 같은 작고 손상되지 않은 유기체에서 형광 염색된 뉴런을 검사하기 위해 선택하는 도구이다.
표면형광은 시편 전체를 한 번에 비춰 모든 형광단이 동시에 빛을 내므로 두꺼운 시편 내에서 특정 초점면의 신호를 관찰하기 어렵다. 공초점 시스템에서 레이저의 빛은 표본의 특정 깊이에 빛을 집중시키는 핀홀 구멍을 통과한다 (그림 B). 이 핀홀 조리개는 초점이 맞춰진 조명을 한 평면으로 제한하지만 다른 영역은 분산되고 덜 강렬한 조명을 받고 초점이 맞지 않는 형광을 방출한다. 그러나 방출된 모든 빛은 감지기에 도달하기 전에 두 번째 핀홀 구멍을 통과한다. 공초점 현미경의 주요 측면은 검출기 앞의 핀홀 구멍이 조명 핀홀과 공초점인 위치에 있다는 것이다. 초점이 맞춰져 배경 형광을 최소화하고 단일 평면에서 선명한 초점을 유지한다. 감지된 빛은 디지털화되어 표시 및 저장을 위해 컴퓨터로 전송된다.
2차원 이미지를 생성하기 위해 초점 평면의 각 지점에서 데이터를 필드 전체를 스캔하여 순차적으로 수집한다. 공초점 현미경은 시편 두께 전체에 걸쳐 정확한 간격으로 레이저 빔의 초점을 맞춰 여러 초점면에서 광학 섹션을 생성할 수 있다. 그런 다음 컴퓨터 이미지 분석을 사용하여 이러한 섹션을 쌓아 최적의 대비 및 해상도로 3차원 볼륨을 재구성할 수 있다.

표준 형광에 대한 공초점 현미경의 주요 이점은 배경 형광 없이 세포 및 세포 구조의 선명한 이미지를 생성할 수 있다는 것이다. 그러나 여전히 한계가 있다. 공초점 레이저는 한 점씩 표본을 스캔하여 표본의 완전한 이미지를 형성한다. 불행히도, 이 스캐닝은 공초점 현미경이 표면형광 현미경보다 더 오랜 기간 동안 샘플을 강한 빛에 노출시켜야 하므로 광표백 및 광독성이 더 문제가 된다. 이미지를 캡처하는 데 필요한 시간이 길어지면 매우 빠른 이벤트의 라이브 셀 이미징에 덜 바람직하다. 또한, 여러 광학 단면을 쌓아서 3차원 재구성을 생성할 수 있는 것이 큰 장점이지만 측면 X-Y 해상도가 Z (깊이) 차원의 해상도보다 미세하므로 3차원 재구성이 뒤틀려 나타날 수 있다. 이러한 단점에도 불구하고 공초점 현미경은 특히 뇌 절편이나 작은 무척추 동물을 검사하는 이미징의 황금 표준이다.
이광자 현미경 (Two-Photon Microscopy)

2광자 레이저 스캐닝 현미경이라고도 하는 2광자 현미경은 정밀 형광 현미경을 더욱 개선한 것이다. epifluorescent 또는 confocal microscopy에서 특정 파장의 빛의 단일 광자는 형광단을 여기시켜 빛을 방출한다. 2광자 현미경에서 형광단은 2개의 광자를 동시에 효과적으로 흡수함으로써 여기될 수 있다. 이 경우 각 광자는 자체적으로 일반적인 여기 파장의 2배인 파장을 가지므로 광자당 에너지 준위가 절반이다. 형광단이 두 개의 저에너지 광자를 동시에 흡수할 때, 각각은 더 많은 에너지와 더 짧은 파장을 가진 단일 광자가 형광단과 상호작용하는 데 필요한 여기 에너지의 절반을 제공한다 (그림 C).
주요 장점은 두 광자의 거의 동시 도달이 극히 드문 경우이므로 형광 여기가 표본 내의 좁은 초점 평면으로 제한된다는 것이다. 이는 광자가 초점 평면에 위치한 여기된 형광단에서만 방출되기 때문에 상대적으로 적은 수의 형광단이 존재하는 경우에도 기존 공초점 현미경보다 선명한 이미지를 제공한다. 따라서 모든 방출된 빛을 수집할 수 있다. 배경 형광을 생성하기 위해 초점 평면 위와 아래에 위치한 형광단을 여기시키기에 충분한 에너지가 없다.
2광자 현미경은 여기 파장이 사용되는 일반적인 파장의 약 2배이기 때문에 공초점 또는 표면형광 현미경보다 조직 (500μm ~ 1mm) 깊숙이 침투할 수 있다. 파장이 긴 빛은 산란이 적어 조직에 더 깊이 침투할 수 있다. 여기가 초점으로 제한되어 있기 때문에 광표백 및 광독성이 적어 2광자 현미경이 전체 동물의 해부되지 않은 살아있는 뇌 조직의 세포 또는 뇌 조각의 미세 규모 신경 구조의 확장된 관찰에 특히 유용하다. 이 방법의 주요 제한 사항은 2광자 현미경 설정에 고가의 특수 레이저 및 장비가 필요하다는 것이다.
TIRF (Total Internal Reflection Fluorescence Microscopy)
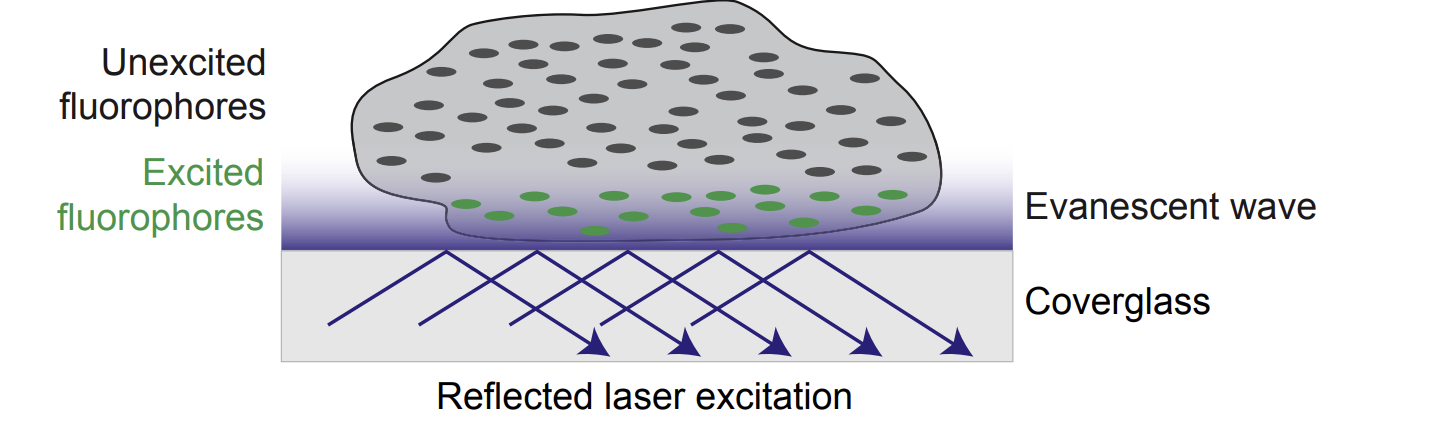
내부 전반사 형광 (TIRF) 현미경은 형광단의 여기 및 검출을 표본의 얇은 부분으로 제한하여 초점이 맞지 않는 형광으로 흐릿한 이미지를 제거하는 데 사용되는 또 다른 방법이다. TIRF 현미경에서 검출의 얇은 부분은 시편과 시편이 장착된 표면 (일반적으로 유리 커버슬립) 사이의 경계면에 고정된다 (그림 12). TIRF 현미경은 표본과 인접한 표면 사이의 경계면에서만 빛의 소멸파로 형광단을 여기시킨다. 소멸파는 거리에 따라 기하급수적으로 감소하며 일반적으로 100nm 깊이에서 샘플로 손실된다. 따라서 원형질막 (~7.5nm 두께)과 바로 인접한 세포질 영역만 효과적으로 여기시킨다.
이 방법은 세포 표면에서 발생하는 분자 및 생화학적 사건을 조사하는 데 유용하다. 예를 들어, 형광단 태그가 붙은 관심 분자는 원형질막과 세포의 세포질에 위치할 수 있다. 형광현미경을 사용하여 막에서 방출되는 형광은 세포질에 있는 훨씬 더 많은 분자 집단에서 나오는 형광에 의해 압도될 수 있다. TIRF 현미경을 사용하면 조사자가 이 분자의 막 결합 집단을 선택적으로 자극하고 이미지화할 수 있다. 이러한 종류의 현미경은 종종 고해상도로 살아있는 세포의 원형질막에서 발생하는 과정을 선택적으로 시각화하는 데 사용된다.
https://www.sciencedirect.com/science/article/pii/B9780128005118000058
Microscopy
The goal of this chapter is to provide a basic description of common forms of microscopy. First, we define the fundamental parameters and parts of a l…
www.sciencedirect.com
'Natural Intelligence > Microscopy' 카테고리의 다른 글
| 전자 현미경 (Electron microscopy) (0) | 2022.03.02 |
|---|---|
| 형광 현미경 (Fluorescence microscopy) (0) | 2022.03.02 |
| 광학 현미경 (Light microscopy) (0) | 2022.03.02 |
| 입체 현미경 설계 (0) | 2022.03.02 |
| 복합 현미경 설계 (0) | 2022.03.02 |



